Periyodik Sistem
Konu Anlatımı
Geçmişten Günümüze Periyodik Sistemin Oluşturulması:
Bileşik ve karışımların temel bileşeni olan elementler, tarihsel süreçte zamanla keşfedilmiştir. Tarihî kaynaklar 1869 yılında yaklaşık 63 tane elementin bilindiğini belirtmektedir. Günümüzde doğada bulunan element sayısının 80 civarında olduğu bilinmektedir. Laboratuar ortamında üretilen yapay elementlerle birlikte toplam element sayısı, 118’dir. Elementlerin incelenmesinde kolaylık olması için elementler gruplandırılmış ve bu şekilde birçok element tablosu oluşturulmuştur.
Tarihte oluşturulan element tablolarını ve özelliklerini biliyor musunuz?
- Elementleri özelliklerine göre gruplandırma ilk çağlardan beri yapıla gelen bir çalışmadır. İlk çağlarda doğada toprak, su, hava ve ateş olarak dört temel elementin olduğu iddia ediliyordu.
- 1800’lü yıllarda kimi zaman elementlerin fiziki özellikleri, kimi zaman kimyasal özellikleri göz önüne alınarak bilinen elementler gruplandırılmıştır. Bu gruplandırmalar sonunda bilim insanları çok farklı tablolar hazırlamıştır.
- Tablolarda bazı özelliklerin periyodik olarak tekrar etmesi sebebiyle bu tablolara elementlerin periyodik tablosu (periyodik sistem)
Tarih Boyunca Oluşturulan Bazı Periyodik Sistemler ve Özellikleri:
- Johann Wolfgank Döbereiner (1780-1849): Bu konuyla ilgili ilk çalışmayı 1829 yılında Johann Döbereiner, benzer özellik gösteren elementlerden üçlü gruplar oluşturarak gerçekleştirmiştir. Ona göre; lityum, sodyum, potasyum benzer özellikler gösterdiği için bir grup oluşturuyordu.
- A.E. Beguyer De Chancourtois (1820-1886): Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak sıralamıştır. Fakat bu listede elementlerin dışında bazı iyonlara ve bileşiklere de yer vermiştir
- John Newlands (1837-1898): Elementleri atom ağırlıklarına göre sıralamıştır. İlk sekiz elementten sonra benzer özelliklerin tekrar ettiğini keşfetmiştir. Oluşturduğu tabloyu müzikteki notalara benzetmiştir.
- Julius Lother Mayer (1830-1895)- Dimitri Mendeleyev (1834-1915): Bu iki bilim insanı birbirinden habersiz aynı sıralamayı elde etmişlerdir. Mayer, elementleri benzer fiziksel özelliklerine göre sıralarken Mendeleyev, elementleri atom ağırlıklarına göre sıralamıştır. Mendeleyev’in oluşturduğu tablo 12 satır ve 8 sütundan oluşmaktadır. Mendeleyev, günümüzde kullandığımız periyodik sisteme benzer bir sistem oluşturmuştur.
- Henry Moseley (1817-1915): 1913 yılında periyodik sistemi atom numaralarına göre düzenlemiştir.
- Glenn Seaborg (1912-1999): Periyodik sistemin en altında yer alan iki sıra hâlindeki elementleri düzenleyerek günümüzdeki periyodik sisteme son şeklini vermiştir.
Periyodik Sistemde Grup Ve Periyotlar:
- Tek bir cins atomdan oluşmuş, kimyasal tekniklerle ayrıştırılamayan ya da farklı maddelere dönüştürülemeyen saf maddelereyse“element”adı veriliyor.
- Dünya üzerinde bilinen elementlerin belirli bir şekilde yerleştirildiği sistem,periyodik tabloolarak adlandırılıyor.
- Elementlerin, soldan sağa ve yukarıdan aşağıya doğru artan atom numaralarına göre diziliminden oluşan bu tabloda, yatay sıralara “periyot“, dikey sütunlaraysa “grup” adı veriliyor.
- Periyodik sistemde toplam 7 periyot vardır. periyot kısa bir periyot olup burada sadece hidrojen (H) ve helyum (He) elementleri bulunur.2. periyotta sekiz element vardır. Bu periyot lityum (Li) elementi ile başlar, neon (Ne) elementi ile sona erer.3. periyotta da sekiz element vardır. Bu periyot sodyum (Na) elementi ile başlar, argon (Ar) elementi ile biter.4. periyotta ise 18 element vardır. Potasyum (K) ile başlayan bu periyot, kripton (Kr) elementi ile sonlanır.
- Periyodik sistemde 18 grup bulunmaktadır. Bu gruplardan 8 tanesi A, 10 tanesi B grubunu oluşturur.
Periyodik Cetvelde Grupların Özellikleri:
Aynı grupta bulunan elementlerin kimyasal özellikleri (sertlik, parlaklık, iletkenlik, reaksiyona girme isteği vb.) genellikle benzerdir. Aynı grupta bulunan elementlerin yukarıdan aşağıya doğru gittikçe;
- Son katmanında elektron sayıları değişmez.
- Atom numarası (Proton sayısı) artar.
- Atom hacmi artar.
- Katman sayısı (Periyot sayısı) artar.
- Bazı grupların özel isimleri vardır.
1A grubu: Alkali metaller
2A grubu: Toprak alkali metaller
7A grubu: Halojenler
8A grubu: Soy (Asal) gazlar
Periyodik Cetvelde Periyotların Özellikleri:
Aynı periyotlarda soldan sağa gittikçe;
- Atom numarası (Proton sayısı) artar.
- Katman sayısı (Periyot sayısı) değişmez.
- Atom hacmi azalır.
- Değerlik elektron sayısı (son yörüngedeki elektron sayısı) artar.
- Metalik özellik azalır, ametalik özellik artar.
- Elektron alma isteği artar.
Periyodik Cetvelde Yer Bulma:
Periyodik sistemde bir elementin yeri 3 adımda bulunur:
- Elementin elektron dağılımı yapılır.
- Katman sayısı elementin periyot numarasını verir.
- Son yörüngedeki elektron sayısı (değerlik elektron sayısı) elementin hangi A grubunda olduğunu belirtir.
Elementlerin Sınıflandırılması:
*Atomun kimliğini atomdaki proton sayısı belirler. Farklı elementlerin de proton sayısı birbirinden farklıdır. Elementlerin sayısı 120 civarındadır. Bunlardan 90 tanesi doğada bulunmaktadır. Bilim insanları elementleri benzer özelliklerine göre sınıflandırmıştır.
*Elementler; metal, ametal ve yarı metal olmak üzere üç gruba ayrılmaktadır.
Aktivite 1
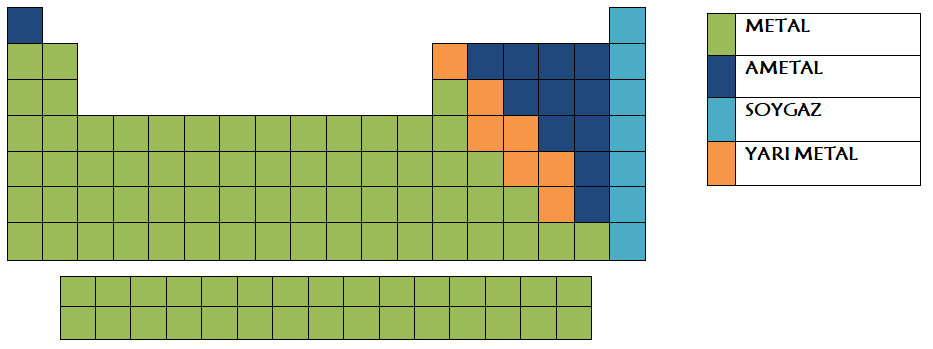
1. Metallerin Genel Özellikleri:
*Tel ve levha haline getirilebilir. (İşlenebilirler.)
*Isı ve elektriği iyi iletir.
*Parlaktır.
*Oda koşullarında katıdır. (Cıva hariç)
*Atomik yapıdadır.
*Kendi aralarında bileşik yapmazlar.
*Ametallerle iyonik bağ yapar.
*Bileşik yaparken elektron vererek “+” yüklü (Katyon) oluşturur.
*Son yörüngelerindeki elektron sayısı (değerlik elektron sayısı) 1,2 veya 3 tür.
*Periyodik cetvelin sol tarafında yer alırlar.
*Demir, bakır, alüminyum, potasyum, kalsiyum, magnezyum, kurşun, kalay ve cıva günlük yaşamda karşılaştığımız metallerden bazılarıdır.
* İlk 18 element içerisindeki metaller; Lityum (Li), Berilyum (Be), Sodyum (Na), Magnezyum (Mg), Alüminyum (Al).
2. Ametallerin Genel Özellikleri:
*Tel ve levha haline getirilemez. (Kırılgandır.)
*Isı ve elektriği iyi iletmez.
*Mattır.
*Oda koşullarında katı, sıvı ve gaz haldedir.
*Molekül yapıdadır.
*Kendi aralarında kovalent bağ yapar, elektronlarını ortaklaşa kullanır.
*Metallerle iyonik bağ oluşturur, elektron alarak “– ” yüklü (Anyon) oluşturur.
*Son yörüngelerinde 4, 5, 6, 7 veya 8 elektron bulundurur.
*Periyodik cetvelin sağ tarafında bulunmaktadır.
* İlk 18 element içerisindeki ametaller; Hidrojen (H), Karbon (C), Azot (N), Oksijen (O), Flor (F), Fosfor (P), Kükürt (S), Klor (Cl), Helyum (He), Neon (Ne) ve Argon (Ar).
Soygazların Genel Özellikleri:
*Parlak değildir.
*Oda sıcaklığında gaz hâlindedir.
*Tel ve levha hâline getirilemez.
*Kararlı yapıda oldukları için elektron almaz ya da vermez, katyon ve anyon oluşturmaz. Yani bileşik oluşturmazlar.
*Doğada atomik halde bulunurlar.
*Erime ve kaynama noktaları çok düşüktür.
* İlk 18 element içerisindeki soy gazlar; Helyum (He), Neon (Ne) ve Argon (Ar).
3. Yarı Metallerin Genel Özellikleri:
*Parlak ve mat görünümdedir.
*Oda koşullarında katıdır.
*Tel ve levha haline gelebilir.
*Isı ve elektriği ametallerden iyi, metallerden kötü iletir.
*Periyodik sistemde kırık çizgi halinde bulunur.
*Bor, silisyum, germanyum, arsenik, tellür ve polonyum yarı metallere örnektir.
*İlk 18 element içerisindeki yarı metaller; Bor (B) ve Silisyum (Si).
*Yarı metaller elektronik devre, projeksiyon ve mercek yapımında kullanılır.

MİLYONER YARIŞMASI
Oyna-Ekle

KADER KISMET
Sınıf İçin Yarışma Oyna-Ekle

BÜYÜK RİSK
Sınıf İçin Yarışma Oyna-Ekle
ONLİNE DENEME
Her Sınıf ve Üniteye Ait Türkiye Sıralamalı
