Maddenin Isı ile Etkileşimi -Türkiye’de Kimya Endüstrisi
Konu Anlatımı

* Isı; sıcaklığı yüksek olan maddeden sıcaklığı düşük olan maddeye aktarılır. Isı alan maddenin sıcaklığı artarken, ısı veren maddenin sıcaklığı azalır.
* Bu ısı alış-verişi (ısı aktarımı) sıcaklıklar eşitleninceye kadar devam eder. Eşitlendiği sıcaklığa “denge sıcaklığı (tD)” denir.
!!! Sıcaklıklar eşitlendikten sonra ısı aktarımı durur. Denge sıcaklığı iki sıcaklık arasında kütlesi büyük olana yakındır
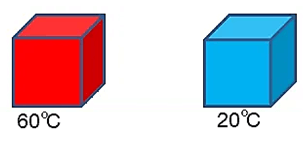
Isı aktarımı kırmızı cisimden mavi cisme doğrudur.
200C < tD < 600C
Öz ısı:
* Saf bir maddenin 1 gramının sıcaklığını 10C arttırmak için verilmesi gereken ısıya “öz ısı” denir.
Öz ısı, saf maddeler için ayırt edici bir özelliktir.
* Sembolü “c” dir.
* Birimleri “j/g. 0C” ve ” cal/g. 0C” dir.
!!! Öz ısı değeri büyük olan maddeler geç ısınır, geç soğur. Öz ısı değeri küçük olan maddeler erken ısınır, erken soğur.
Öz ısının Özellikleri:
- * Öz ısı saf maddeler için ayırt edici özelliktir.
- * Saf maddelerin öz ısıları da farklıdır. (Yoğunluk, erime noktası, kaynama noktası, donma noktası da maddenin ayırt edici özellikleridir.)
- * Öz ısı maddenin miktarına bağlı olarak değişmez.
- * Eşit miktarda farklı cins sıvılara eşit miktarda ısı verildiğinde öz ısısı az olan sıvının sıcaklığı daha fazla artar.
- * Eşit miktarda farklı cins sıvıların çevreye verdikleri ısı, öz ısısı fazla olanın daha fazladır.
Not: 1 gram suyun sıcaklığını 1°C artırabilmek için 1 kalori ısı vermek gerekir.(1 cal = 4,18’ j dür.)
Örnek: Meltem rüzgarlarımın oluşmasındaki temel faktör; özısı farklılığıdır. Suyun özısısı, karanın öz ısısından büyüktür. Bu yüzden karalar erken ısınır, erken soğur. Karalar gündüz erken ısındığı için rüzgarın yönü denizden karaya doğrudur. Denizler geç ısınır, geç soğur. Denizler geç ısındığı için gece rüzgarın yönü denizden karaya doğrudur.
Örnek:
c demir =0,4 j/g. 0C
c cam =0,837 j/g. 0C
Güneş altında kalan arabanın metal kısımlarının sıcaklığı, cam kısımlarının sıcaklığından fazladır.
Isı – Kütle İlişkisi:
* Isı ile kütle doğru orantılıdır. (Aynı cins ve eşit sıcaklık olmalıdır.)
Kütle azalırsa ısı azalır.
Kütle artarsa ısı artar.
Bağımlı Değişken : Isı
Bağımsız Değişken : Kütle
Kontrol Değişkeni : Özısı ve sıcaklık
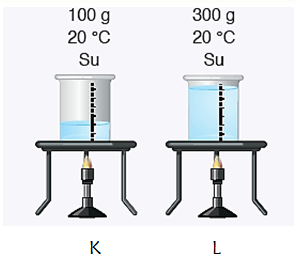
* Üstteki 100 g ve 300 g su bulunan kapların ilk sıcaklıkları aynı özdeş ısıtıcılarla ısıtıldığın da L kabını daha uzun süre ısıtmak gerekir. K ve L kaplarının 1000C ulaşma süreleri farklıdır.
* L kabının ısıtılma süresi çok olduğundan sahip olduğu enerji daha fazladır. L kabı K kabından daha fazla buz eritir.
Isı – Özısı İlişkisi:
* Isı ile özısı doğru orantılıdır. (Eşit kütle ve eşit sıcaklık olmalıdır.)
Özısı azalırsa verilmesi gereken ısı azalır.
Özısı artarsa verilmesi gereken ısı artar.
Bağımlı Değişken : Isı
Bağımsız Değişken : Özısı
Kontrol Değişkeni : Kütle ve sıcaklık
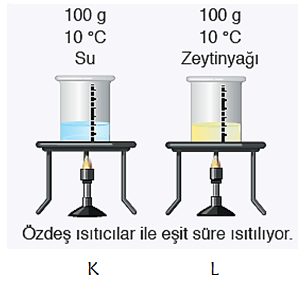
* Üstteki 100 g su ve 100 g zeytinyağı bulunan kapların ilk sıcaklıkları aynıdır. Özdeş ısıtıcılarla ısıtıldığında K kabını daha uzun süre ısıtmak gerekir. Çünkü suyun özısısı zeytinyağının özısısından büyüktür. K ve L kaplarının 1000C ulaşma süreleri farklıdır.
* K kabının ısıtılma süresi ve ihtiyacı olan ısı L kabından daha fazladır.
Sıcaklık – Kütle İlişkisi:
* Kütle ile sıcaklık ters orantılıdır. (Aynı cins olmalı ve eşit ısı verilmelidir.)
Kütle azalırsa sıcaklık artışı artar.
Kütle artarsa sıcaklık artışı azalır.
Bağımlı Değişken : Sıcaklık artışı
Bağımsız Değişken : Kütle
Kontrol Değişkeni : Özısı ve ısı
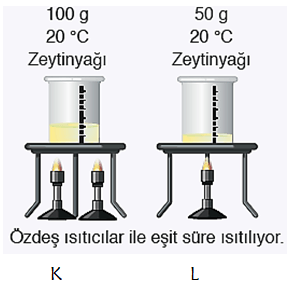
* Üstteki 100 g su ve 50 g zeytinyağı bulunan kapların ilk sıcaklıkları aynıdır. Özdeş ısıtıcılarla eşit süre ısıtıldığında L kabının sıcaklığı K kabından daha yüksek olur. Çünkü L kabında daha az tanecik vardır ısıyı daha az tanecik paylaşacağı için sıcaklık daha yüksek olur.
* K kabının ısıtılma süresi ve ihtiyacı olan ısı L kabından daha fazladır.
Isı – Sıcaklık İlişkisi:
* Isı ile sıcaklık doğru orantılıdır. (Aynı cins ve eşit kütle olmalıdır.)
Isı azalırsa sıcaklık artışı azalır.
Isı artarsa sıcaklık artışı artar.
Bağımlı Değişken : Sıcaklık artışı
Bağımsız Değişken : Isı
Kontrol Değişkeni : Özısı ve kütle
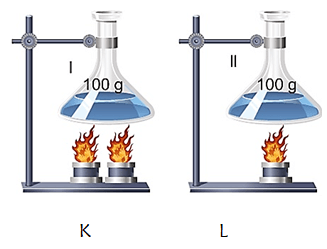
* Üsttekii 100 g su K ve L bulunan kapların ilk sıcaklıkları aynıdır. Farklı miktarda ısı verildiğinde L kabının sıcaklığı daha fazla olur. Çünkü suyun K kabına verilen ısı miktarı L kabından büyüktür. Aynı sıcaklığa ulaşmaları için L kabı daha uzun süre ısıtılmalıdır.
Özısı – Sıcaklık İlişkisi:
- Özısı ile sıcaklık artışı ters orantılıdır. (Eşit kütlede olmalı ve eşit ısı verilmelidir.)
- Özısı azalırsa sıcaklık artışı artar.
- Özısı artarsa sıcaklık artışı azalır.
Bağımlı Değişken : Sıcaklık artışı
Bağımsız Değişken : Özısı
Kontrol Değişkeni : Kütle ve ısı
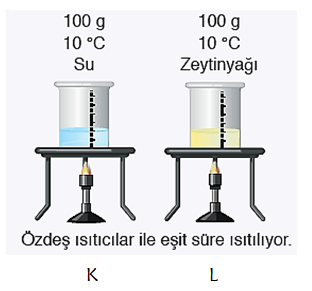
* Üstteki 100 g su ve 100 g zeytinyağı bulunan kapların ilk sıcaklıkları aynıdır. Özdeş ısıtıcılarla eşit süre ısıtıldığında L kabının sıcaklığı K kabından daha yüksek olur. Çünkü zeytinyağının öz ısısı sudan küçüktür.
Hal Değişimi
* Maddelerin ısı alarak ya da ısı vererek bir halden başka bir hale geçmesine hal değişimi denir. Maddelerin; katı, sıvı ya da gaz hâlde bulunması, taneciklerinin birbirine yakın ya da uzak olmasına bağlıdır. Katı maddelerin tanecikleri, çekim kuvvetinin etkisinden dolayı birbirine çok yakındır. Sıvı maddelerin tanecikleri arasındaki çekim kuvvetleri katılara göre zayıf, gazlara göre ise daha güçlüdür.
* Isı alan taneciklerin hareketi artar. Bu hareket arttıkça tanecikler birbirinden uzaklaşır, hal değişimi başlar. Isı veren taneciklerin hareketi azalır. Bu hareket azaldıkça tanecikler birbirine yaklaşır, hal değişimi başlar.
(Bağ Kuvveti: Katı > Sıvı >Gaz)
* Hal değişimi için alınması veya verilmesi gereken ısı; maddenin kütlesine ve cinsine bağlıdır.
Madde ısı verir. Bağlar kurulur. Tanecikler yaklaşır.
Madde ısı alır. Bağlar kopar. Tanecikler uzaklaşır.
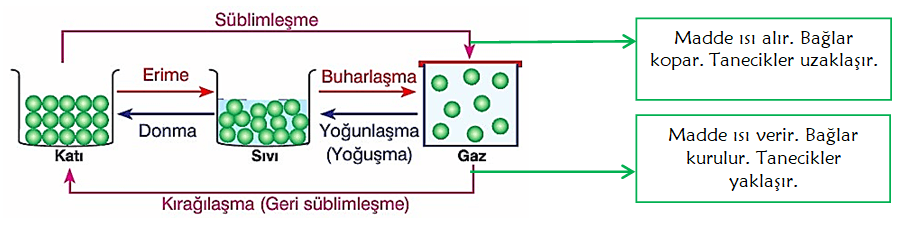
* Hal değişiminde sıcaklık sabit kalır. Çünkü madde aldığı ısıyı sadece hal değişimi için kullanır.
* Maddenin hal değişimi için belli sıcaklıkları vardır. Hal değiştirme sıcaklıkları madde miktarına bağlı değildir. Maddenin cinsine bağlıdır. Saf maddeler için hal değiştirme sıcaklıkları ayırt edici bir özelliktir. Hal değişimi ısı alış-verişi ile gerçekleşir.
Erime:
* Katı bir maddenin ısı alarak sıvı hale geçmesi sırasında gerçekleşen hal değişimine erime denir. Erimenin gerçekleştiği sıcaklığa erime noktası (erime sıcaklığı) denir.
* Erime sıcaklığında bulunan 1 gram saf katı maddenin aynı sıcaklıkta 1 gram sıvı haline gelmesi için verilmesi gereken ısı miktarına erime ısısı denir.
Erime ısısı LE ile gösterilir.
Birimleri j/g veya cal/g ‘dır.
* Erime ısısı ve erime sıcaklığı saf katı maddeler için ayırt edici bir özelliktir.
Donma:
* Sıvı bir maddenin ısı vererek katı hale geçmesi sırasında gerçekleşen hal değişimine donma denir. Donmanın gerçekleştiği sıcaklığa donma noktası (donma sıcaklığı) denir.
* Donma sıcaklığında bulunan 1 gram saf sıvı maddenin aynı sıcaklıkta 1 gram katı haline gelmesi için alınması gereken ısı miktarına donma ısısı denir.
Donma ısısı LD ile gösterilir.
Birimleri j/g veya cal/g ‘dır.
* Donma ısısı ve donma sıcaklığı saf sıvı maddeler için ayırt edici bir özelliktir.
*Saf maddelerde erime noktası, donma noktasına; erime ısısı, donma ısısına eşittir.
Örnek:
Buz 00C’de erir.
Su 00C’de donar.
LD =334,4 j/g
LE =334,4 j/g
* Saf bir maddenin içine başka bir madde karıştırılırsa maddenin saflığı bozulur. Saf olmayan bu karışımların erime ve donma sıcaklıkları saf maddelerden farklıdır.
Örnek: Buzun çekim kuvveti, su taneciklerinin çekim kuvvetine göre daha fazladır. Tuz, alkol gibi maddeler, tanecikler arası çekim kuvvetini azaltarak maddenin donma ısısını azaltır.
Örnek: Tuzlu suyun donma sıcaklığı 00C’nin altına iner (Tuz miktarına göre değişkenlik gösterir.). Kışın yollara tuz atılması suyun donma noktasını düşürerek buzlanmayı geciktirir.
Saf olmayan maddelerin belirli bir donma sıcaklığı yoktur.
Örnek: Deniz ve okyanusların donmamasının nedeni deniz ve okyanus sularının tuzlu ve kütlesinin büyük olmasıdır. Dere ve göller ise 00C’nin altında donabilmektedir.
Buharlaşma:
* Sıvı bir maddenin ısı alarak gaz hale geçmesi sırasında gerçekleşen hal değişimine buharlaşma denir. Buharlaşma noktası yoktur. Buharlaşma her sıcaklıkta gerçekleşir. Buharlaşma bir hal değişimidir.
* Sıvının tamamında buharlaşma meydana geliyorsa bu olaya kaynama denir. Kaynama bir hal değişimi değildir. Kaynamanın gerçekleştiği sıcaklığa kaynama sıcaklığı(kaynama noktası) denir.
* Kaynama sıcaklığında bulunan 1 gram saf sıvı maddenin aynı sıcaklıkta 1 gram gaz haline gelmesi için verilmesi gereken ısı miktarına buharlaşma ısısı denir.
Erime ısısı LB ile gösterilir.
Birimleri j/g veya cal/g ‘dır.
* Buharlaşma ısısı ve kaynama sıcaklığı saf sıvı maddeler için ayırt edici bir özelliktir.
Örnek: Kolonya dökülen elin serinlemesi, banyo veya denizden çıkınca üşümemiz, toprak testideki suyun serin kalması, kesilen karpuzun serin kalması,…vb. olaylar buharlaşma ile gerçekleşir. Buharlaşma ısı alan bir olay olduğu için ortamın sıcaklığı düşer.
Yoğuşma:
* Gaz bir maddenin ısı vererek sıvı hale geçmesi sırasında gerçekleşen hal değişimine yoğuşma denir. Yoğuşmanın gerçekleştiği sıcaklığa yoğuşma noktası (yoğuşma sıcaklığı) denir.
* Yoğuşma sıcaklığında bulunan 1 gram saf gaz maddenin aynı sıcaklıkta 1 gram sıvı haline gelmesi için alınması gereken ısı miktarına yoğuşma ısısı denir.
Yoğuşma ısısı LY ile gösterilir.
Birimleri j/g veya cal/g ‘dır.
* Yoğuşma ısısı ve yoğuşma sıcaklığı saf gaz maddeler için ayırt edici bir özelliktir.
* Saf maddelerde yoğuşma noktası, kaynama noktasına; yoğuşma ısısı, buharlaşma ısısına eşittir.
Örnek: Buzdolabından çıkarılan şişenin üzerinde su damlacıklarının oluşması yoğuşmadır. Ortamda bulunan su buharı soğuk yüzeye çarpınca ısı vererek sıvı hale geçer.
TÜRKİYE’DE KİMYA ENDÜSTRİSİ
* Kimya endüstrisi birçok sektör için gerekli hammadde ihtiyacını karşılar.
* Türkiye; Dünya kimya endüstrisinde %0,44 oranında pay sahibidir.
* Kimya endüstrisinin başlıca çalışma alanlarının bazıları aşağıdaki gibidir.
- . Petrokimya
- . Elyaf – tekstil
- . Boya – kozmetik
- . Şeker – nişasta
- . Çimento – alçı
- . Özel kimyasallar
- . Endüstriyel gazların üretimi
- . Sabun – deterjan
- . Yarı iletkenler
- . Otomotiv
- . Cam – seramik
Kimya Endüstrisinin Tarihi:
* 1926’da ilk şeker fabrikası (Alpullu) kurulmuştur.
* 1934-1938 yıllarında “Birinci Beş Yıllık Sanayileşme Planı” hazırlanmıştır. Bu plan doğrultusunda; şeker, dokuma, maden, selüloz ve seramik fabrikalarının kurulması plana bağlanmıştır.
* 1935’te Türkiye şişe ve cam fabrikası (İstanbul) kurulmuştur.
* 1938’ te Suni İpek Fabrikası (Gemlik) kurulmuştur.
* 1950’lerden sonra ulaşımın gelişmesi, şehirde iş gücünün artması, özel sektörün sanayiye yatırım yapması, sanayinin gelişmesi ve çeşitlenmesini sağlamıştır.
* 1955’te ilk rafineri Batman’da kurulmuştur.
* 1961’de İzmit’ te kurulan rafineri ile LPG, motorin, fuel oil, jet yakıtı, gaz yağı üretilmiş ve bir kısmı ihraç edilmiştir.
* 1965’ te İzmir’de Petkim kurulmuştur.
* 1970’ lerden sonra yapay gübre ve asit üretimi gelişme göstermiştir.
Örnek:
. İzmit’ te klor ve kostik soda fabrikası
. Karabük’te asit, sülfürik asit, amonyum, sülfat ve naftalin üreten kuruluşlar
. Bandırma’da, sülfürik asit ve borik asit fabrikaları
* 1980’den sonra şehirlerin çevrelerinde küçük sanayi siteleri açılmıştır.
* İlaç Sanayi : İstanbul ve yakın çevresindedir.
* Boya Sanayi : İstanbul, İzmir ve Mersin’dedir.
İthalat ve İhracat Ürünleri:
* Türkiye’nin dış ülkelere ürün satmasına ihracat, sattığı ürünlere ihracat ürünleri denir. Türkiye’nin dış ülkelerden ürün almasına ithalat, aldığı ürünlere ithalat ürünleri denir.
İthalat ve İhracat Oranları:
Yukarıdaki grafikte görüldüğü gibi Türkiye kimya endüstrisinde dışa bağımlıdır.
Bu durum nasıl tesrine çevrilir?
– Araştırma geliştirme (AR-GE) çalışmaları yapmak.
– Ekonomik getirisi yüksek ürünler üretmek
Kimya Endüstrisinin ile İlgili Meslek Dalları:
* Kimyagerlik: Maddelerin kimyasal nitelikleri, molekül yapıları ve her cins kimyasal örneğin analizi konusunda çalışmalar yapan meslek grubudur.
* Kimya Mühendisliği: Kimyagerlerin çalışmalarını ekonomik ve büyük ölçüde üretime, ürüne dönüştürmek için gerekli üretim süreçlerini ve fabrikaları tasarlar. Bunu yaparken fizik, kimya ve matematik bilgilerini tasarlar.
* Kimya Teknisyenliği: Her türlü kimyasal ham maddenin üretimi, kalite kontrolü ve analizde araştırma- geliştirme laboratuvarlarında kimya mühendisleri ve kimyagerlerin denetiminde çalışan kişilere verilen unvandır.
Kimya Endüstrisinin ile İlgili İlişkili Olan Meslek Dalları:
- * Gıda mühendisliği
- * Ziraat mühendisliği
- * Tıp doktorluğu
- * Petrol ve doğalgaz mühendisliği
- * Biyoteknoloji
- * Uzay mühendisliği
- * Nanoteknoloji
- * Bilişim teknolojileri
- * Bor mühendisliği

MİLYONER YARIŞMASI
Oyna-Ekle

KADER KISMET
Sınıf İçin Yarışma Oyna-Ekle

BÜYÜK RİSK
Sınıf İçin Yarışma Oyna-Ekle
ONLİNE DENEME
Her Sınıf ve Üniteye Ait Türkiye Sıralamalı
