Karışımlar
Konu Anlatımı
Karışım birden fazla maddenin kendi özelliklerini kaybetmeden oluşturdukları maddelerdir.
Tuz ve su karıştırıldığında özelliklerini kaybetmezler.
Karışımların Genel Özellikleri:
- Saf değildir.
- Homojen ya da heterojen olabilir.
- Belirli bir formülleri yoktur.
- Fiziksel yollarla oluşur.
- Fiziksel yöntemlerle bileşenlerine ayrıştırılabilir.
- Belirli hâl değişim sıcaklıkları yoktur.
- Karışımı oluşturan maddeler özelliklerini korur.
Karışımlar görünümlerine göre ikiye ayrılır.
Örneğin, tebeşir tozu ile suyu karıştırdığımızda tebeşir karışımın her tarafında aynı miktarda bulunmaz.
Tebeşir tozu karışımın üst tarafında daha çok diğer kısımlarında ise daha az miktarlarda bulunur.
Karışımı oluşturan maddeler karışımın her tarafına eşit miktarlarda dağılmıyorsa bu tür karışımlara heterojen karışım adı verilir. Adi karışımlar bir tür heterojen karışımdır.
Karışımı oluşturan maddeler karışımın her tarafına eşit olarak dağılmışsa bu tür karışımlar homojen karışımlardır. Çözeltiler homojen karışımlardır.
Örneğin, bir miktar şeker ile suyu karıştırdığımızda şeker ile su karışımın her tarafında eşit oranda bulunur.
HETOREJEN KARIŞIMLARIN ÖZELLİKLERİ
- Heterojen özellik gösterirler.
- Bulanık görünürler.
- Dipte çökelti oluştururlar.
- Genellikle tanecikleri gözle görülür.
- Fiziksel yolla (süzme) ayrılırlar.
HETEROJEN KARIŞIMLARA ÖRNEKLER

Kum-su Kahve Tebeşir tozu-su Çamur Çay Salata Süt Kan Ayran Toprak Demir tozu-Kükürt Tozu Meyve suyu Zeytin yağı-su Sis Beton Hoşaf Deodorant Sprey
UYARI: Çıplak gözle bakıldığında homojen gibi görünen bazı karışımların mikroskopla bakıldığında heterojen olduğu gözlenir.
Örneğin, mineral ve vitamin gibi besinler içeren süt çıplak gözle bakıldığında homojen gibi görünür. Mikroskopta incelendiği zaman ise yağ zerreciklerinin belirli kısımlarında daha fazla bulunduğu görülür ve sütün heterojen olduğu anlaşılır.
HOMOJEN KARISIMLAR(ÇÖZELTİLER)
Günlük hayatta çözelti adını kullanmasak bile çözeltilerle iç içe yaşıyoruz.
Soluduğumuz hava, içerisinde bazı canlıların yaşadığı sular, içtiğimiz meşrubatlar, diş dolgusunda kullanılan amalgamlar, kullandığımız metal paralar, hepsi birer çözeltidir.

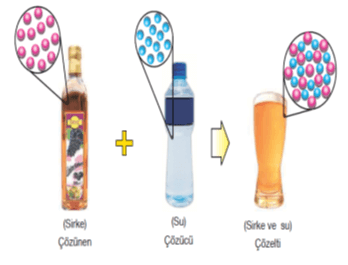
Çözeltileri oluşturan maddelerden miktarı çok olan çözücü, az olan da çözünen olarak adlandırılır. Fakat sulu çözeltilerde suyun miktarı az bile olsa su çözücü olarak kabul edilmektedir.
Örneğin, bir bardak suya bir kaşık şeker eklenerek hazırlanan çözeltide, su çözücü, şeker ise çözünen maddedir.
ÇÖZELTİ TÜRLERİ
KATI-KATI ÇÖZELTİLER:
Alaşımlar örnek olarak verilebilir.
- Çelik : Karbon-Nikel-Krom
- Lehim : Kurşun-Kalay
- Tunç : Bakır-Kalay
- Pirinç : Bakır-Çinko
- Amalgam : gümüş-Cıva
- Madeni para :bakır-nikel-çinko
SIVI-SIVI ÇÖZELTİLER:
- Sirke : Su-asetik asit
- Kolonya : Su- etilalkol
KATI-SIVI ÇÖZELTİLER
- Tentürdiyot :İyot-Etilalkol
- Şekerli-su :Şeker-Su
- Tuzlu-su :Tuz-Su
- Burun damlası :Safsu-Tuz
SIVI-GAZ ÇÖZELTİLER:
- Gazoz :Su-Karbondioksit
- Deniz Suyu :Su-Oksijen
GAZ-GAZ ÇÖZELTİLER
Hava : Azot-Oksijen-Karbondioksit
Çözünme Olayı
Çözelti oluşurken çözücü ve çözünen maddeler arasında bir etkileşim olur. Çözünen maddenin tanecikleri çözücü ile etkileşerek birbirinden ayrılır ve çözücünün her tarafına dağılır. Bu dağılma sırasında çözücünün tanecikleri çözünenin taneciklerinin etrafını sarar.
Böylece çözücü ve çözünen maddeler en küçük birimine kadar ayrılır.
Çözünme, çözücü ve çözünen maddelerin birbiri içinde iyonlarına veya moleküllerine ayrılmasıdır.
ÇÖZÜNME HIZINA ETKİ EDEN FAKTÖRLER
- Sıcaklık
- Tanecik boyutunu küçültme
- Karıştırma
- Çözücü ve Çözünen miktarı
1.Sıcaklık
Çözeltilerde, sıcaklığın arttırılması, çözünme hızını arttırır, Sıcaklık arttırıldığında çözücü ve çözünen maddeyi oluşturan taneciklerin hızları artar. Hızlı hareket eden çözücü maddenin tanecikleri, çözünen maddenin taneciklerin etrafını daha hızlı sararak çözünme olayını hızlandırır.

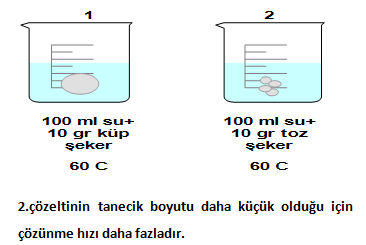
- Tanecik boyutunu küçültme
Çözeltilerde, çözünen maddenin tanecik boyutunun küçültülmesi, yani maddenin ufalanıp toz haline getirilmesi katı haldeki maddelerin çözünme hızını arttırır. Çözünen maddenin tanecik boyutu küçültüldüğünde, çözücü maddenin tanecikleri, daha fazla çözünen maddenin taneciği ile temas eder yani etrafını sarar ve bu nedenle çözünme olayı hızlanır
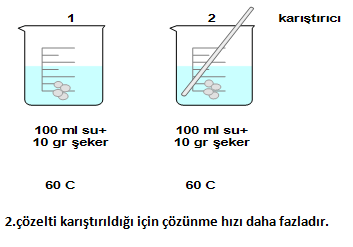
- Karıştırma, sallama
Çözeltiyi karıştırmak veya sallamak çözünme hızını artırır ve çözünme süresini kısaltır.
- Çözücü ve çözünen madde miktarı
Çözücü miktarı artarsa çözünme hızı artar, Çözünen miktarı artarsa çözünme hızı azalır.

MİLYONER YARIŞMASI
Oyna-Ekle

KADER KISMET
Sınıf İçin Yarışma Oyna-Ekle

BÜYÜK RİSK
Sınıf İçin Yarışma Oyna-Ekle
ONLİNE DENEME
Her Sınıf ve Üniteye Ait Türkiye Sıralamalı
